Де знаходиться Колоноскопія у Дніпрі?
Хто лікуе Вагітність у Дніпрі?
Реклама 2026:
Наш досвід свідчить про принципову можливість використання VAC-терапії в торакальної хірургії, його відносній простоті й ефективності, особливо в поєднанні з ультразвуковою кавітацією і прицільною антибактеріальною терапією.

УДК 617.541-002.3: 616-089.819.6
[1] КЗ «Дніпропетровська обласна клінічна лікарня ім. І.І. Мечникова»,
[2] ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна,
[3] КЗ «Дніпропетровська міська багатопрофільна клінічна лікарня №4» ДОР м. Дніпро, Україна
Висока ефективність використання вакуум-терапії (Vacuum–assisted closure, VAC-терапії) у лікуванні гнійних та трофічних ран різної локалізації у теперішній час не викликає сумніву. Водночас використання VAC-терапії є досить новим і прогресивним направленням торакальної хірургії, що дозволяє покращити результати лікування хворих [8,9]. VAC-терапія розглядається як альтернатива при гнійних ускладнення з боку післяопераційної рани при різних видах торакальних операцій. Метод є безпечним, економічним, дозволяє скоротити терміни одужання та реабілітації пацієнтів [6].
Загально прийняте використання VAC-терапії при лікуванні гнійних ускладнень після стернотомії, що супроводжується розвитком післяопераційного медіастиніту. Метод дозволяє активно дренувати середостіння, сприяє активному очищенню рани, знижує інфільтрацію та запалення, що сприяє підготовці для подальшого пластичного закриття дефекту [5]. Негативний тиск забезпечує не тільки непереривне видалення ексудату і очищення рани, але і стимулює проліферацію грануляційної тканини. Отримані результати проведених досліджень свідчать про зниження всіх показників, що характеризують процес запалення на тлі вакуум-терапії, на відміну від хворих, які не отримували цей вид лікування [1,2]. Використання VAC-терапії при стерномедіастиніті знижує рівень летальності, тривалість госпіталізації та ризик виникнення рецидиву захворювання [4]. Однак, необхідні подальші дослідження, що будуть спрямовані на вдосконалення технології VAC-терапії у комплексному лікуванні хворих з післяопераційними стерномедіастинітами та визначення оптимальних термінів реконструктивних торакоміопластичних втручань [3].
В останні роки відмічається зростання кількості хворих з гнійними деструктивними процесами в легені, перебіг яких нерідко ускладнюється плевритом з подальшим розвитком емпієми плеври [12]. Лікування хворих з емпіємою плеври є складна проблема, що пов’язана з тривалим лікуванням пацієнта, хронізацією процесу, інвалідизацією хворих та високими показниками летальності. Сучасні тенденції хірургії полягають у максимально можливому зменшенні операційно-анестезіологічної травми.
Перші повідомлення про внутрішньоплевральну терапію VAC були опубліковані в 2006 році [14]. Система VAC-терапії розглядається як альтернативний варіант лікування ускладнених абсцесів легені у літніх, знесилених хворих після невдалого консервативного лікування. Але метод можливо використовувати тільки при локалізації абсцесу біля вісцеральної плеври, складності виникають при розташуванні абсцесів паравертебрально, парамедіастинально та апікально [19]. Інші автори розглядають VAC-терапію при лікуванні післяопераційної емпієми плеври після пневмонектомії у поєднанні з торакостомією та торакопластикою, вважаючи такий підхід ефективним та безпечним [10]. При цьому наявність бронхоплевральної нориці або залишеної долі легені після резекції не є протипоказом до використання VAC [16], а на противагу при цьому ускладнені після пульмонектомії розглядається як єдиний варіант лікування [13].
Hans-Stefan Hofmann та співав. використали VAC в лікуванні залишкових порожнин при емпіємі плеври без відкритої торакостомії. Виконання мінідоступу та ретрактору для ран дозволило досягти очищення та закриття порожнини емпієми [11]. Метод Mini-VAC з відмовою від традиційної торакостомії пропонує швидке лікування емпієми плеври з мінімальним хірургічним втручанням і можливістю первинного закриття порожнини емпієми [17]. При порівнянні Mini-VAC з традиційною торакостомією встановлено покращення безпосередніх та віддалених результатів лікування при використанні VAC-терапії [18]. Сучасною модифікацією Mini-VAC терапії є Mini-VAC-Instill терапія, що включає мініторакостомію, місцеву декортикацію та вакуум-терапію з введенням розчину антисептиків. Метод вважається альтернативним у тяжких хворих з емпіємою плеври та дозволяє досягти інфекційного контролю у 85,7% пацієнтів [15].
Крім того, знайшло свої місце використання VAC-терапії при масивній підшкірній емфіземі при значному надходженні повітря у тканини грудної стінки, що дозволило авторам зменшити емфізему та пов’язані з нею негативні симптоми на тлі адекватного дренування плевральної порожнини [7].
проаналізувати можливості використання вакуум-терапії при гнійних ураженнях грудної стінки та плевральної порожнини.
В гнійно-септичному центрі Дніпропетровської обласної клінічної лікарні ім. І.І. Мечникова за період з 2017 по 2018 роки проведено лікування 16 хворих на гнійну торакальну патологію з використанням VAC-терапії. Вік хворих коливався від 19 до 65 років, середній вік - 39 років. Переважали чоловіки – 12 (75%) осіб.
В залежності від нозології хворі були розділені на три групи. До I групи увійшли 7 пацієнтів з остеомієлітом грудини і грудино-реберних зчленувань після стернотомії з приводу кардіохірургічної патології. В 5 (71,4%) з них страждали супутнім цукровим діабетом, що є фактором ризику у цієї категорії пацієнтів.
До II групи віднесли 5 пацієнтів з гнійною патологією грудної порожнини, що була ускладненням інших гнійних захворювань. Серед них 3 хворих – з одонтогеними флегмонами шиї, з розвитком медіастиніту і емпієми плеври, 2 - з неспецифічними (стафілококовими) спондилітами грудних хребців з розвитком паравертебральних абсцесів і емпієми плеври.
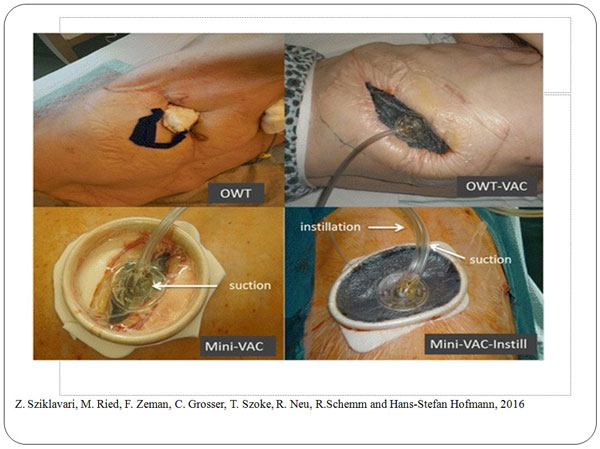
Третю групу склали 4 пацієнта з вогнепальними проникаючими пораненнями грудної клітини, що були отримані у зоні бойових дій на сході України. У цих постраждалим після виконання торакотомії на етапах надання медичної допомоги у ранньому післяопераційному періоді виникли явища гнійної інфекції торакотомної рани з виникненням торакостоми та емпієми плеври.
Терміни госпіталізації до відділення склали від 14 діб до 6 місяців від початку захворювання.
При обстежені хворих використовували загальноклінічні та біохімічні лабораторні методи дослідження, рентгенографію органів грудної клітки у двох проекціях, ультразвукове дослідження плевральної та черевної порожнини, мультиспіральну комп’ютерну томографію. При наявності показань використовували фістулографію, ангіографію, плеврографію.
Для проведення VAC-терапії використані вітчизняні апарати дніпровської фірми «Агат-Дніпро», що дозволяють проводити вакуумування рани як у безперервному, так в інтермітуючому режимах. Ультразвукову кавітацію проводили апаратом Sorring Sonoca 190. Режим кавітації при обробці м’якотканинних структур і порожнин склав 60 кГц, а при обробці відкритих кісткових і сухожильних структур – 40 кГц, середня тривалість сеансу 5-8 хвилин. У якості рідини для ультразвукової кавітації використовували 400 мл фізіологічного розчину з додаванням 80 мг гентаміцину.
Проведено порівняльний аналіз впливу вакуум-терапії та її поєднання з ультразвуковою кавітацію на динаміку ранового процесу шляхом оцінки ступеня мікробної контамінації гнійних ран на 3,8,11,16 та 21 добу лікування. Було сформовано дві групи порівняння, до першої групи увійшли 9 хворих, яким використана VAC-терапія з ультразвуковою кавітацією, до другої – 7 пацієнтів, які лікувалися за допомогою лише VAC-терапії. При оцінці ступеня мікробної контамінації ран використовували метод мазків-відбитків з визначенням колонієутворювальних одиниць мікробного навантаження (Lg KУО / г). Характер та динаміку змін клітинного складу рани під впливом VAC-терапії та кавітації досліджено за допомогою мазків-відбитків за ран з оцінкою клітинного складу на 3,8 та 11 добу лікування у цих же групах. Мазки-відбитки забарвлювали за Папенгеймом.
Статистичну обробку даних проводили із застосуванням програмних пакетів EXCEL 2000 та Statistica 6.0. Для визначення достовірності застосовували критерій Ст?юдента при довірчому інтервалі p<0,05. Дослідження проводилося відповідно стандартів біоетики, були схвалені етичним комітетом установи, де проведено дослідження. На проведення дослідження було отримано проінформовану згоду всіх пацієнтів.
В I групі хворих в залежності від глибини ураження виконували остеонекректомію грудини, резекцію грудино-реберних зчленувань, дренування переднього середостіння при наявності медіастиніту. Контрастування уражених кісткових і хрящових структур за допомогою тріамбрасту з наступною радикальною секвестректомією в більш пізньому періоді (понад 6 міс) поєднувалося з делікатної санацією структур в перший місяць розвитку ускладнення. При цьому в післяопераційному періоді рани залишалися широко відкритими для проведення VAC-терапії. При цьому лікувальні заходи щодо санації гнійної рани і гнійної порожнини поєднувалися із застосуванням ультразвукової кавітації.
При виборі вакуум-режиму у хворих І групи з огляду на відсутність анатомічних структур, які можливо пошкодити поролоном, застосований постійний режим з тиском 125 мм рт ст у вигляді постійного впливу і без захисних мембранних прошарків. Кількість сеансів VAC-терапії при лікуванні стерномедіастиніті - від 3 до 12, що становила від 2-х тижнів до 2-х місяців. VAC-сеанс тривав від 3-х до 5 діб в залежності від кількості ексудату.
Поява здорових грануляцій не тільки по периферії рани, але і покриття грануляціями кісткових структур дозволяло з упевненістю проводити пластику рани для закриття шкірного дефекту. Важливим моментом в лікуванні остеомієліту грудини, на нашу думку, є збереження її первинної післяопераційної фіксації. Різні фіксуючі металоконструкції, навіть при розвитку остеомієліту, обов’язково зберігали. Після зрощення частин грудини фіксатори видаляли і лікування остеомієліту повторювали. Раннє видалення фіксаторів грудини призводило до розвитку флотуючої грудної клітки та трофічних ран, що тривало не загоюються.
Важливим моментом лікування цієї категорії хворих вважали тривалу, з урахуванням мікробної чутливості, антибактеріальну терапію, яка у деяких випадках складала до двох місяців. Частіше використовували антибіотики, спрямовані на грампозитивну флору (тейкопланін, лінезолід, ванкоміцин).
В ІІ групі прогресування гнійної інфекції з розповсюдженням на середостіння та плевральну порожнину потребувало проведення торакотомії у всіх хворих. Виконували дренування середостіння або паравертебрального гнійника з санацією плевральної порожнини. У всіх хворих в післяопераційному періоді виникли гнійні ускладнення із сторони торакотомной рани з розвитком торакостоми та емпієми плеври. За умови збереження дренажів для санації гнійної порожнини був встановлений поролон на область рани в захисному мембранному футлярі для запобігання «прилипання» і пошкодження легеневої тканини. Поролонові дренажі або поліетиленові мембрани максимально поширювали по плевральній порожнині. Захист легеневої тканини дозволив використовувати сприятливий режим 125 мм.рт.ст. Після очищення та облітерації плевральної порожнини, появи щільних і здорових грануляцій поролон встановлювали вже без мембранних захистів, використовували їх тільки з дренажною метою. VAC-терапія дозволила максимально швидко очистити плевральну порожнину, рану, розправити легеню і через 5-7 сеансов провести хірургічне закриття грудної стінки без дренування. Заміна VAC системи відбувалася під знеболенням, що дозволяло провести ультразвукову кавітацію рани і гнійних порожнин та адекватно встановити поролон.
У цій групі померла одна хвора на тлі важкого діабету і прогресування серцевої недостатності. Ефективність VAC- терапії у лікуванні цього важкого контингенту хворих зробила можливою зміну тактики: не ушивання рани грудної стінки, а залишення її відкритою (за аналогією з етапним лікуванням перитоніту) і накладення VAC-терапії на першому етапі санації.
У ІІІ групі хворих з вогнепальними пораненнями грудної клітки та гнійними ускладнення з боку післяопераційної рани та плевральної порожнини у всіх випадках проводили хірургічну обробку рани, некрєктомію, при наявності показань, та накладали систему VAC-терапії, герметизуючи дефект грудної стінки. Захисних пристосувань на шкіру або ребра не використовували, навпаки наявність поролона в рані сприяло її більш швидкому очищенню. Перші сеанси VAC-терапії також проводили із захисними мембранами для легеневої тканини, однак накопичення досвіду надало можливість сміливіше використовувати VAC-терапію. Контакт поролону із легенею не призводив до травми останньої, а можливе прилипання викликало лише капілярну кровотечу, яку легко зупиняли застосуванням колагенових губок. Наявність бронхо-плевральних нориць не була протипоказом до використання VAC-терапії. Початкові сеанси VAC-терапії поєднували з дренуванням плевральної порожнини для діалізу і санації, в подальшому було досить мембранних «пелюстків» для збору ексудату. Розправлення легені на тлі прямого вакуум-ефекту і її фіксація до грудної стінки, очищення рани сприяло створенню умов для закриття шкірного дефекту на 5-8 сеанс VAC-терапії (15-26 доба). Загинув один постраждалий з поєднаним тяжким пораненням головного мозку.
При проведені порівняльного аналізу впливу вакуум-терапії та її поєднання з ультразвуковою кавітацію рани встановлено, що рівень мікробного забруднення ран на 3 добу лікування достовірно не відрізнявся (таб. 1). Але подальша оцінка динаміки ранового процесу вказує на більш швидке зниження рівня мікробного забруднення рани під впливом поєднаної терапії ультразвукової кавітації і VAC-терапією, ніж в II групі, з достовірною різницею показників на 16 та 21 добу лікування (p<0,05).
Таблиця 1. Ступінь мікробної контамінації ран в залежності від виду лікування

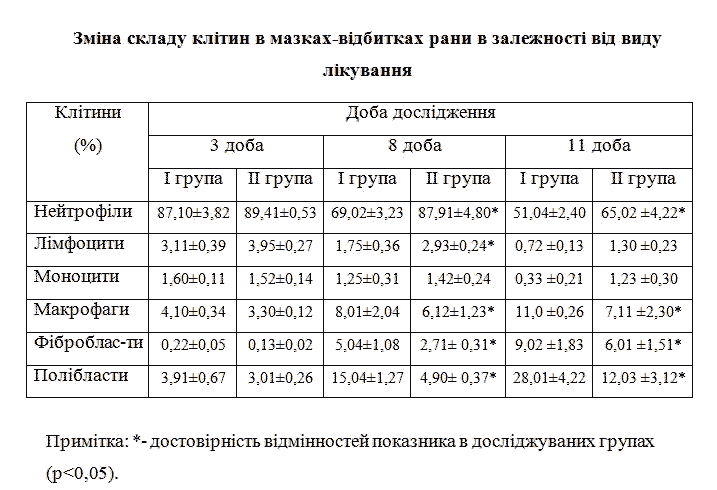
При аналізі динаміки клітинного складу рани у групах порівняння було визначено, що з 8-11 доби лікування, тобто після 3-4 сеансу VAC-терапії, суттєво змінюється клітинний малюнок рани: нейтрофільно-лімфоїдна популяція клітин, яка переважала в перші дні ранового процесу, замінюється на клітини, що визначають процеси очищення та регенерації в рані у вигляді макрофагів, фібробластів і полібластів (таб. 2). Ці зміни є важливими критеріями позитивного ефекту лікування, зростання здорових грануляцій і готовності рани до різних видів пластичного закриття. Слід зазначити, що ці зміни клітинного складу рани були більш динамічними та достовірно відрізнялися в І групі дослідження в зазначені терміни лікування (p<0,05).
Таблиця 2. Зміна складу клітин в мазках-відбитках рани в залежності від виду лікування
Отже, сучасні уявлення про прискорення очищення рани та скорочення термінів агресивного апаратного лікування дозволяють активно застосовувати ультразвуковий вплив на гнійний рановий процес. Ультразвуковій обробці підлягає не тільки поверхнева рана, а й гнійні порожнини. Застосування ультразвукової кавітації під час зміни вакуум-системи сприяє очищенню рани від мікробних тіл швидше, ніж тільки застосуванням VAC-системи. А герметизація рани захищає від повторного контамінування і зберігає чистоту рани.
Таким чином, використання вакуум-терапії при гнійній торакальній патології є ефективним сучасним підходом лікування цієї складної категорії хворих. Якщо використання VAC-терапії при стерномедіастинітах є загально визнаним, то здебільшого досвід використання VAC-терапії при абсцесах легені, емпіємі плеври та пораненнях грудної клітки базується на невеликій кількості випадків, що обумовлює подальше накопичення та узагальнення даних щодо особливостей та можливостей VAC-терапії при цій патології. Наш досвід свідчить про принципову можливість використання VAC-терапії в торакальної хірургії, його відносній простоті й ефективності, особливо в поєднанні з ультразвуковою кавітацією і прицільною антибактеріальною терапією.
Перспективи подальших досліджень у даному напрямку: накопичення досвіду застосування VAC-терапії при різній торакальній патології, розробка нових хірургічних підходів щодо лікування цієї категорії хворих з використанням вакуум-терапії та аналіз їх результатів.
Дата публікації: 2018.10.18
Statistics: 846